一.论坛简介
实验室自建项目(LDTs)是指没有获得CFDA批准,仅在开发的医学检验实验室中使用的检测项目,随着转化医学和个体化医学检验需求的发展,并且由于高新技术的监管总是落后于技术发展,许多基于高新检测技术的检测都未被列入我国的临检项目目录,尤其是像分子诊断、基因检测、RNA生物标志物、ctDNA检测、肿瘤易感基因检测等新兴检测技术。另一个事实是,我国医学实验室开展的临床检测项目大约有1500项,其余都属于LDTs项目,而国外可检测的项目已达4000-5000种,未来必然有不少成熟的LDTs将被列入临检项目,从提高医疗服务水平和促进新技术应用的角度看,我国推动LDTs监管和开放LDTs也将成为必然趋势。
另一方面,美国FDA正在加紧计划管理所有第三方医学检验机构的检验项目,为兼顾体外诊断产品的质量安全和行业技术创新,国外基本采用FDA+LDTs监管的主流模式,我国体外诊断产品的监管由CFDA负责,对LDTs的监管更加严厉,政策上对LDTs的监管目前还不清晰。2016年,国家卫计委发布了关于临床检验项目管理有关问题的通知,提出对临床意义明确、特异性和敏感性较好、价格效益合理的临床检验项目可通过合理审核,促进在临床上第一时间使用,可谓是为一些优质 LDTs 项目设“绿色通道”。
为探讨新兴检测技术和手段在国内独立检验实验室的发展情况和未来趋势,新政策环境下LDTs的监管、发展及向成熟检测项目的转化,基于此,预计第三方独立医学实验室将迎来快速发展。生物谷将举办2017年第三方检验实验室发展论坛,邀请精通国内外LDTs监管的专家和行业领军人物和创新企业,聚焦新兴检测技术的发展和LDTs的监管问题,共同探讨独立医学实验室发展的讨论与机遇。
二.举办地点及时间
举办地点:中国上海 举办时间:2017.3.30-31
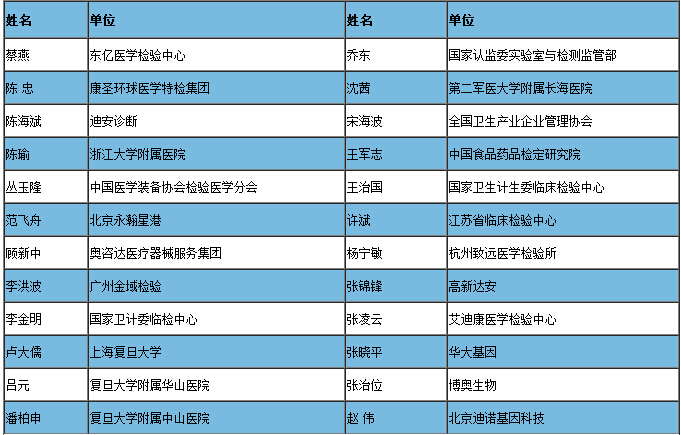
三.论坛嘉宾

四.论坛议题

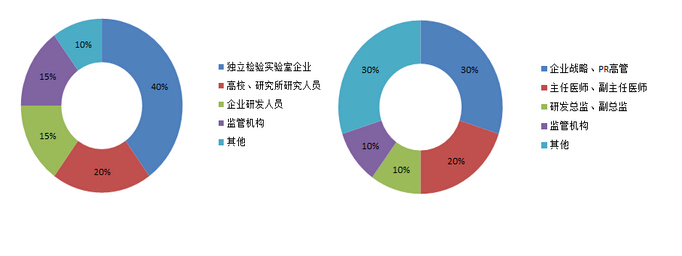
五.参会人群
六.联系方式
